Wokół Arduino. Pomiary wilgotności, część 1
W kursie Arduino wykorzystujemy różne czujniki wilgotności. Otwierają one drogę do pomiaru wilgotności nie tylko w naszych mieszkaniach. Mogą posłużyć do wielu interesujących celów, ale do tego potrzebna jest nieco szersza wiedza na temat wilgotności.
Mierniki i czujniki wilgotności
Od wielu lat w naszych domach obecne są „stacje meteo”, w tym elektroniczne. Trudno powiedzieć, czy rzeczywiście wykorzystujemy ich wskazania, czy może są jedynie atrakcyjną ozdobą naszych mieszkań. Pierwsza kwestia to dokładność ich wskazań. Druga to pytanie, czy dobrze rozumiemy i do czego jest nam potrzebna wartość wilgotności.
To samo pytanie dotyczy coraz tańszych elektronicznych modułów czujników wilgotności (humidity sensors). Budzą one żywe zainteresowanie elektroników, ale też są powodem błędnych wyobrażeń.
Tanie higrometry i czujniki często pokazują, co chcą, a po pewnym czasie ich wskazania nie mają prawie nic wspólnego z wilgotnością względną. Najczęściej są to pojemnościowe czujniki polimerowe. Materiałem czynnym jest specjalny polimer – tworzywo sztuczne o dobranym składzie (co jest tajemnicą producentów), którego przenikalność dielektryczna znacząco zależy od zawartości pary wodnej w otaczającym powietrzu. Tego rodzaju czujniki dostępne są od dawna. W roku 2001 w EdW przedstawiony był prosty projekt, „Higrometr elektroniczny”, którego podstawą był czujnik polimerowy HS15. Niestety, wskazania tego czujnika silnie zależą od temperatury. Wspomniany artykuł zawierał wskazówki, jak uzyskać informację o wilgotności względnej, ale nie jest to łatwe. Generalnie, by uzyskać wartość wilgotności względnej (RH), wskazania wszystkich elektronicznych czujników wilgotności, zarówno pojemnościowych, jak też rezystancyjnych, muszą być w dość skomplikowany sposób przetworzone z uwzględnieniem aktualnej temperatury.
Z biegiem czasu powstały czujniki, zawierające w jednej obudowie nie tylko czujnik wilgotności i czujnik temperatury, ale też elektroniczny, cyfrowy układ przetwarzający i linearyzujący. Największy problem to trwałość i powtarzalność właściwego czujnika wilgotności, czyli niezmienność właściwości polimeru, wystawionego przecież na działanie czynników atmosferycznych.
Niestety, do dziś jest to problem nawet w czujnikach renomowanych firm.
Starzenie i inne zmiany parametrów są wprawdzie nieuniknione, ale warto wiedzieć, że istnieje zaskakująco prosty, zaskakująco tani i zaskakująco dokładny sposób sprawdzania i kalibracji czujników wilgotności względnej (czemu poświęcony będzie oddzielny artykuł).
Gdyby problemem było tylko powolne starzenie, można byłoby okresowo przeprowadzać prostą kalibrację, jedno-, dwu- albo kilkupunktową. Niestety, jest też problem histerezy, a niektóre czujniki z niewiadomych powodów albo całkowicie odmawiają posłuszeństwa, albo ich właściwości zmieniają się nieodwracalnie i wskazania daleko wykraczają poza granice podane w katalogu. Dotyczy to przede wszystkim czujników rodziny DHT, w tym jeszcze niedawno popularnych czujników DHT-11, które według aktualnych opinii są bardzo zawodne. Niestety, podobne opinie, choć trzeba przyznać, w znacznie mniejszym stopniu, dotyczą najbardziej popularnego aktualnie czujnika DHT-22 (AM2302) chińskiej produkcji (Aosong/ ASAIR www.aosong.com)
Lepszą opinią cieszą się zespolone czujniki wilgotności i temperatury innych firm, w tym Sensirion (SHT), Bosch (BME) czy Honneywell (HIH).
Warto przyjrzeć się ich kluczowym parametrom, w tym także specyfice i ograniczeniom. Ale zanim to zrobimy, trzeba odpowiedzieć na kluczowe pytanie…
Po co komu higrometr?
Najprostsza odpowiedź jest taka: optymalna wilgotność względna w mieszkaniu to 40…50%. Wartości 30…65% uznawane są za dobre, a przynajmniej akceptowalne. Wilgotność poniżej 30% nie jest wskazana dla organizmu i może wywoływać nieprzyjemne odczucia (suchość skóry i dróg oddechowych). Wilgotność powyżej 70% też nie jest dobra, zarówno dla organizmu człowieka, jak też dla przedmiotów znajdujących się w mieszkaniu. Wilgotność bliska 100%, nawet jeśli występuje okresowo, w pewnych warunkach grozi zawilgoceniem i zagrzybieniem mieszkania.
Miernik wilgotności względnej jest więc pomocny w każdym mieszkaniu. Jednak jest to zastosowanie najprostsze, dotyczące mieszkań, gdzie wahania temperatury są stosunkowo małe, rzędu kilku stopni Celsjusza. Do kontroli wilgotności w mieszkaniu wystarczy higrometr, którego wskazania są wiarogodne w stosunkowo wąskim zakresie zmian wilgotności i temperatury.
Oprócz tego czujniki wilgotności są też potrzebne w innych, „trudniejszych” zastosowaniach, gdzie zdecydowanie szerszy jest zarówno zakres zmian temperatury, jak i ściśle z tym związanych zmian wilgotności względnej. W wielu takich zastosowaniach wartość wilgotności względnej niesie bardzo mało informacji – zdecydowanie bardziej przydatna i miarodajna jest informacja albo o wilgotności bezwzględnej, albo o tak zwanym punkcie rosy. Chodzi między innymi o zawilgocenie domów i pomieszczeń. Trzeba rozumieć wchodzące tu w grę kluczowe zagadnienia.
Tylko dla dociekliwych
Należałoby zacząć od tego, że powietrze zawiera jakąś niewielką ilość pary wodnej i właśnie wilgotność jest miarą zawartości pary wodnej w powietrzu. Zawartość pary możemy podać na przykład w gramach na metr sześcienny powietrza – to tak zwana wilgotność bezwzględna, absolutna, czasem oznaczana AH – Absolute Humidity.
Najczęściej mówimy jednak o wilgotności względnej powietrza. Nietrudno zrozumieć podstawową ideę. Otóż łatwo zaakceptować fakt, że powietrze może zawierać ograniczoną ilość pary. Jeśli akurat zawiera maksymalną ilość pary, mówimy, że jego wilgotność względna wynosi 100%. Jeśli nie zawiera ani trochę pary wodnej, jego wilgotność względna wynosi 0%. Mówimy tu o wilgotności względnej oznaczanej RH lub %RH – Relative Humidity. Idea jest, jak widać prosta, ale…
Problem w tym, że maksymalna ilość pary wodnej w powietrzu zależy od temperatury. Czym niższa temperatura, tym mniej wilgoci może być zawarte w powietrzu. To znaczy, że wilgotność względna RH równa 100% nie odpowiada jednej konkretnej wartości wilgotności bezwzględnej AH wyrażanej w gramach na metr sześcienny! Maksymalna wilgotność, odpowiadająca 100-procentowej wilgotności względnej, silnie i nieliniowo zależy od temperatury – do tego jeszcze wrócimy. Wcześniej trzeba jednak wyjaśnić pewne nieścisłości.
Wilgotność 100% RH nazywana bywa wilgotnością nasycenia. A słowo „nasycenie” może kojarzyć się z rozpuszczaniem soli w wodzie i z roztworem nasyconym. Wodny roztwór nasycony soli to taki roztwór, w którym stężenie rozpuszczonej soli jest maksymalne i więcej soli nie może się w nim rozpuścić. Na zasadzie analogii, narzuca się wyobrażenie rozpuszczania pary wodnej w powietrzu i wyobrażenie, że w powietrzu nie zmieści się więcej pary wodnej. Zgodnie z takim wyobrażeniem, „wilgotność nasycenia” (100% RH) rozumiana jest jako „stan nasycenia powietrza parą wodną”, gdy nie można rozpuścić więcej pary wodnej w powietrzu. Takie stwierdzenia i wyobrażenia korzeniami sięgają wieku XVIII (!), gdy uważano, że aby woda parowała, niezbędne jest powietrze i że powietrze rozpuszcza parę wodną.
Rzeczywiście, zawartość pary wodnej w powietrzu jest ograniczona, ale absolutnie nie wynika to z jakiegoś „rozpuszczania”. Parowanie wody nie wymaga obecności powietrza. W gazach pod normalnym ciśnieniem odległości między atomami są ogromne w stosunku do średnicy atomów i można powiedzieć, że gaz jest „prawie pusty”. W tej pustej przestrzeni między atomami zmieściłaby się niemal dowolnie duża ilość pary wodnej.
Zmieściłaby się, ale… problem wcale nie polega na braku miejsca!
Wszystko zależy od energii cząstek wody. Otóż cząstki H2O przyciągają się i w „normalnych” warunkach woda jest cieczą. Poszczególne cząsteczki wody mają jakąś energię mechaniczną (kinetyczną): drgają i nieustannie się zderzają. Temperatura jest miarą średniej energii kinetycznej tych cząstek, ale poszczególne cząstki mają energię mniejszą albo większą od średniej. Jeżeli któraś cząstka przy powierzchni cieczy zyska energię większą niż średnia, to może przezwyciężyć siły przyciągania cząstek H2O. Taka cząstka „wyrwie się z wody” i stanie się cząstką pary wodnej w powietrzu. Nazywamy to parowaniem wody.
Liczba cząstek, które w ten sposób „wyrywają się z wody”, zależy od temperatury, czyli średniej energii cząstek. Czym wyższa temperatura, tym większa średnia energia drgań cząstek wody i tym większe jest prawdopodobieństwo, że jakaś cząstka przy powierzchni zyska energię na tyle dużą, żeby „wyrwać się z wody”.
Mówimy, że woda paruje – wody ubywa, a powietrze staje się coraz bardziej wilgotne. W powietrzu jest coraz więcej pary wodnej, a to oznacza też coraz większe ciśnienie tej pary (tak zwane ciśnienie parcjalne – ciśnienie samej pary wodnej z pominięciem innych składników powietrza).
Tak! Ale zawartość pary wodnej i ciśnienie parcjalne nie mogą rosnąć dowolnie.
Owszem, czym wyższa temperatura, tym szybsze jest parowanie wody. Zjawiskiem tym rządzi przypadek i statystyka. Ale podobnie przypadek i statystyka rządzą zachowaniem cząstek pary wodnej, które już są w powietrzu i też poruszają się, zderzają z innymi cząstkami/atomami i mają większą lub mniejszą chwilową energię. Czym wyższa temperatura, tym większa jest średnia energia ruchu cząstek pary w powietrzu, co możemy nieprecyzyjnie określić, że „chętniej się one poruszają”.
Z jednej strony oznacza to, że cząsteczki pary po „wyrwaniu się z wody” mogą szybko oddalić się od jej powierzchni, by równomiernie (wskutek dyfuzji) rozproszyć się w otaczającym powietrzu, co oznacza wyrównanie parcjalnego ciśnienia pary wodnej w całej objętości powietrza. Z drugiej strony niektóre cząstki pary wodnej przypadkowo trafiają w pobliże wody i „wpadają do wody” – następuje skraplanie pary wodnej. Czym więcej jest cząstek pary wodnej w powietrzu, tym więcej cząstek „wpada z powrotem do wody”. Mamy więc do czynienia z dwoma jednocześnie zachodzącymi zjawiskami: cały czas występuje parowanie, ale też cały czas następuje skraplanie. Jeśli szybkość skraplania zrówna się z szybkością parowania, wystąpi stan równowagi, który niezbyt precyzyjnie nazywany jest stanem nasycenia. I tak maksymalna zawartość wody (pary) w powietrzu zostaje ograniczona.
Otóż jeżeli mamy zamknięte naczynie z wodą, to z czasem wytworzy się w nim stan równowagi ciecz/para: zgodnie z prawami statystyki (i przypadku), w danym czasie tyle samo cząstek „wyrwie się z wody” i tyle samo „wpadnie do niej z powrotem”.
Zilustrujmy to prostym przykładem: jeżeli do słoika wlejemy odrobinę wody i szczelnie słoik zamkniemy, to z czasem ta odrobina wody całkowicie wyparuje. Oczywiście będzie też występować skraplanie, ale dominujące będzie parowanie, co doprowadzi do „zniknięcia wody” i wzrostu wilgotności powietrza w słoju.
Jeśli jednak tej wody w zamkniętym słoiku będzie znacznie więcej, to wyparuje tylko część wody. Rosnąca wilgotność powietrza spowoduje wzrost szybkości skraplania i po pewnym czasie tempo skraplania i parowania się zrównają. Wilgotność powietrza wzrośnie do maksymalnego poziomu. W takim stanie równowagi (nasycenia) wilgotność względna (RH) wyniesie dokładnie 100% – nasz słoik z wodą na dnie stanie się wzorcem wilgotności (100% RH).
Jeżeli ten szczelnie zamknięty słoik z wodą ogrzejemy i pozostawimy w wyższej temperaturze, to z czasem wyparuje jeszcze trochę wody, wilgotność bezwzględna wzrośnie i znów ustali się nowy stan równowagi (nasycenia) odpowiedni dla danej temperatury, a wilgotność względna RH nadal będzie wynosić 100%.
Jeżeli z kolei będziemy oziębiać słoik i zawarte w nim substancje, to spadek temperatury i średniej energii ruchu cząstek spowoduje zmniejszenie parowania. Wcześniej w powietrzu znajdowało się dużo pary wodnej; obniżenie temperatury spowoduje, że część tej pary skropli się, m.in. na ściankach słoika, jak pokazuje fotografia 1 (w tym przejściowym okresie szybkość skraplania będzie większa od szybkości parowania). Po pewnym czasie znów ustali się nowy stan równowagi (nasycenia): wilgotność bezwzględna się obniży, ale nadal wilgotność względna będzie równa 100%.
W każdym przypadku ciśnienie parcjalne i zawartość pary w powietrzu ustalą się tu na maksymalnym poziomie, zależnym od temperatury, czyli średniej energii cząstek.
Fizyka i błędne poglądy
Tu warto dodać i wyjaśnić kilka szczegółów. Otóż to samo zjawisko „uwalniania się” cząstek dotyczy także niskich temperatur, gdy woda jest w stanie stałym – jest lodem. Wprawdzie średnia energia drgań cząstek jest wtedy mała, ale nieliczne cząstki wskutek wymiany energii między sobą przez chwilę mogą mieć energię dużo większą niż średnia. Dotyczy to też cząstek przy powierzchni lodu: nieliczne zyskają przez chwilę dużą energię, która wystarczy do „wyrwania się” z bloku lodu, by stać się parą wodną w powietrzu. Nie nazywamy tego „parowaniem lodu”, tylko sublimacją. Mówiąc fachowo, sublimacja to bezpośrednia przemiana fazowa ciała stałego w gazowe z pominięciem fazy ciekłej. Trzeba też wiedzieć, że oprócz sublimacji, występuje też zjawisko odwrotne: resublimacja, czyli bezpośrednia przemiana fazowa gazu (pary wodnej) w ciało stałe (lód).
Dochodzimy tu do kwestii przemian fazowych. Także w przypadku wody mamy do czynienia z trzema dwukierunkowymi przemianami fazowymi: parowanie (ewaporacja) – skraplanie (kondensacja); sublimacja – resublimacja oraz topnienie – krzepnięcie.
Przypomnijmy najważniejsze: w przypadku wody (H2O) mówimy, że występuje ona w stanie ciekłym w temperaturach od 0 do +100 stopni Celsjusza. Poniżej 0°C jako ciało stałe (lód), a powyżej +100°C jako gaz (para wodna). W zasadzie tak, ale…
Trzeba pamiętać, że para wodna, czyli woda w postaci gazowej, występuje w powietrzu w całym zakresie temperatur, także w temperaturach ujemnych.
Ponadto mogą wystąpić pewne przypadki szczególne, jak na przykład przechłodzona woda, która w temperaturach ujemnych pozostaje ciekła. Także podczas ochładzania powietrza wilgotność względna może okresowo być dużo większa niż 100%, jeśli w powietrzu nie będzie „zarodników” skraplania (kurz, pył). Inna sprawa, że definicja stanu równowagi oraz maksymalnej i względnej wilgotności dotyczy wilgotności nad gładką powierzchnią wody. Najogólniej mówiąc, jeżeli parująca warstwa wody (lub lodu) nie jest gładka, tylko ma mikronierówności, to mówiąc najprościej, ma większą powierzchnię i cząstki wody są „słabiej trzymane”, przez co parowanie jest większe, więc maksymalne ciśnienie parcjalne i wilgotność mogą być większe, niż przy powierzchni gładkiej. Jeśli chcesz – samodzielnie zbadaj takie szczegóły.
Koniecznie trzeba jednak nawiązać do zjawisk, z którymi się spotykamy w życiu. I do błędnych wyobrażeń. Z garnka lub czajnika z wrzącą wodą często wydobywa się mgiełka, którą nazywamy parą. Niektórzy skłonni są uważać, że mgła i chmury to właśnie para wodna.
NIE! Para wodna jest gazem i jest przezroczysta, niewidoczna! „Para” nad wrzątkiem to maleńkie kropelki wody, które powstały podczas ochładzania gorącej pary. Mgła to też mikroskopijne kropelki wody. Tworzenie się chmur to wykraplanie kropelek wody lub kryształków lodu tak leciutkich i maleńkich, że unoszą się w powietrzu. Gdy kropelki łączą się w większe, cięższe krople, zaczyna padać deszcz. Często obserwowane „znikanie” chmur to parowanie tych maleńkich kropelek/kryształków lodu i zamiana ich w niewidoczną parę.
Szereg interesujących przemian fazowych wody występuje podczas zimy. I tak można zaobserwować, że nawet podczas mrozów pomału samoczynnie znika warstwa ubitego śniegu – lodu, np. na chodniku. To przykład sublimacji. Zdecydowanie bardziej widowiskowy jest proces odwrotny: resublimacja. Jej efektem jest m.in tworzenie pięknych zimowych widoków, dzięki osadzaniu się na przedmiotach szronu. Szron i śnieg jest efektem resublimacji, natomiast podobna do szronu szadź powstaje przy ujemnych temperaturach z kropelek (przechłodzonej) wody. A gołoledź czy grad to efekt zamarzania mniejszych lub większych kropelek wody.
W praktyce zwykle większe znaczenie ma częściej występujące i mniej widowiskowe zjawisko, jakim jest skraplanie, czyli kondensacja. Z jednej strony jest to zjawisko korzystne, czego przykładem jest poranna rosa, a z drugiej strony może być bardzo groźne i prowadzić do zawilgocenia, a nawet zagrzybienia mieszkań, piwnic, itp.
I właśnie żeby uniknąć zagrożeń, trzeba dokładnie rozumieć pojęcia i parametry związane z wilgotnością.
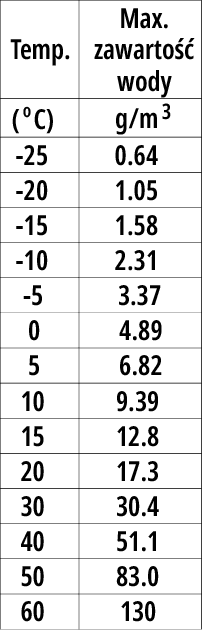
Już wiemy, że maksymalna ilość pary wodnej, jaka może znajdować się w powietrzu, silnie zależy od temperatury. Pokazuje to tabela 1, przedstawiająca, ile gramów wody (pary wodnej) może maksymalnie zawierać 1 metr sześcienny powietrza.
Jak widać, zależność jest silnie nieliniowa. Zauważ, że na przykład w temperaturze 0°C może zawierać niecałe 5 gramów pary wodnej. Ale w temperaturze +40°C będzie to ponad 50 gramów.
W temperaturze 0°C wilgotność względna 100% oznacza zawartość wody 4,89g/m3, natomiast w temperaturze +40°C wilgotność względna 100% to zawartość wody 51,1g/m3. Zawartość 25,55g/m3 w temperaturze +40°C oznacza wilgotność względną 50%.
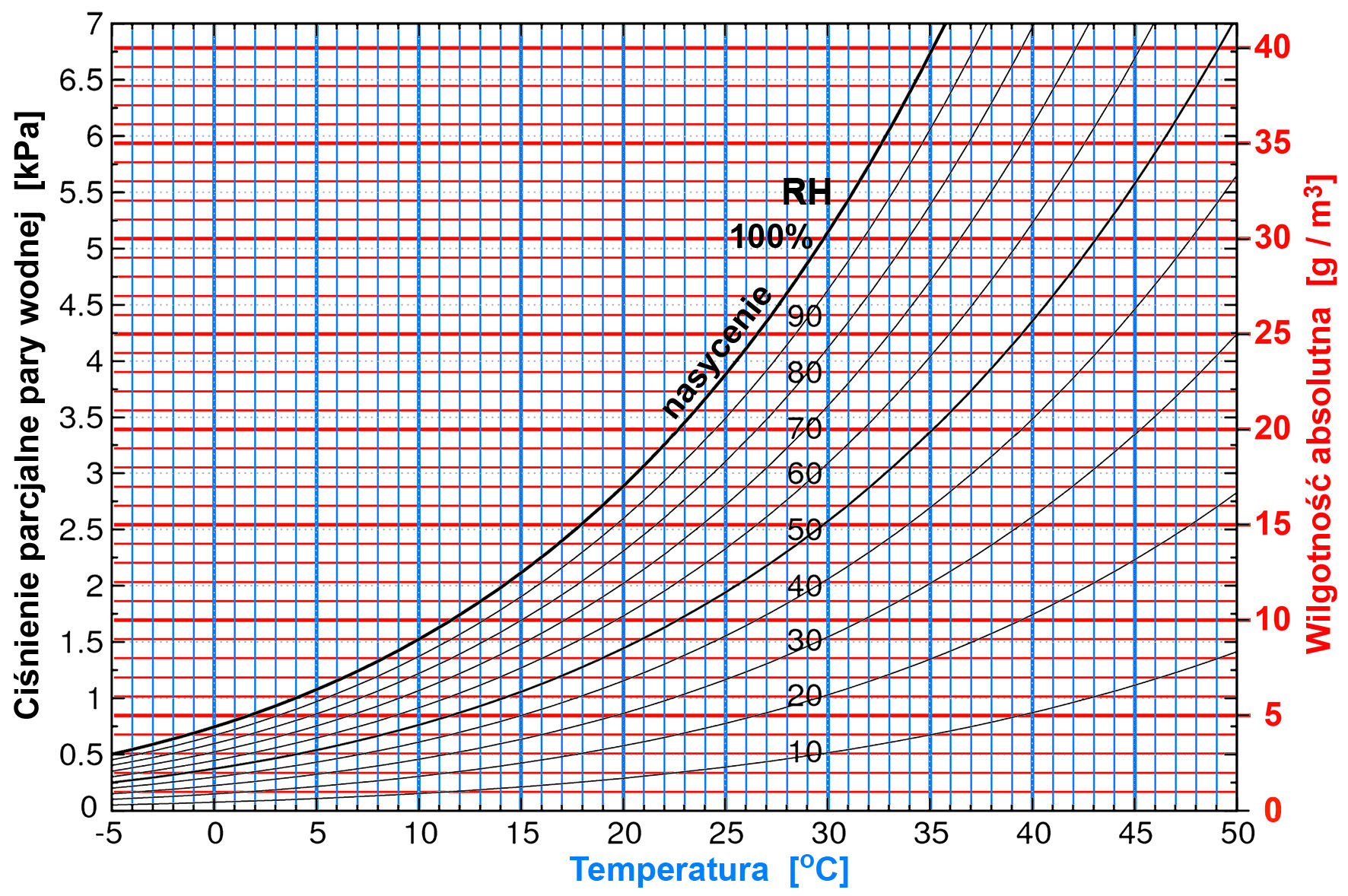
Na rysunku 2 znajdziesz krzywe, pozwalające m.in. określić wilgotność absolutną, czyli zawartość wody w powietrzu przy różnej wilgotności względnej i w różnych temperaturach. W literaturze można znaleźć podobne wykresy z wilgotnością właściwą, czyli ilością gramów pary wodnej zawartą w 1kg powietrza wilgotnego (co akurat łatwo przeliczyć, bo 1m3 powietrza waży około 1,2kg).
Na razie omówiliśmy wilgotność absolutną i wilgotność względną. Potrafimy już wyliczyć zwartość wody w powietrzu o danej temperaturze i wilgotności względnej. Za miesiąc omówimy kolejny bardzo ważny parametr związany z wilgotnością powietrza – punkt rosy.
Piotr Górecki